
-
お電話でのお問い合わせ03-6712-5985
- お問い合わせ
お電話でのお問い合わせ03-6712-5985


先発対後発両サイドの特許戦略に必要不可欠な知識や最近の話題をお届けする「医薬品特許戦略ブログ」を配信します。製薬関連企業の皆様はもちろん、アカデミアや投資家の皆様にも参考にしていただけるような、実践的なポイントをお届けしたいと思います。
2025年5月27日付け東レ株式会社プレスリリースによりますと、同日、かねてより注目を集めていたナルフラフィン侵害訴訟事件の知財高裁本訴判決(令和3年(ネ)10037)が出されました。筆者が知る限り、史上最高額となる218億円の損害賠償が言い渡されました。そこで判決文の公開を待ちながら、「夜明け前」として、これまでの経緯をご紹介いたします。
東レが製造販売する経口そう痒症改善剤「レミッチ®」(「レミッチ®カプセル2.5µg」および「レミッチ®OD錠2.5µg」(一般名:ナルフラフィン塩酸塩)の用途特許(特許第3531170号)に関する以下の一連の事件をナルフラフィン事件の全貌と捉えています。(独自見解)
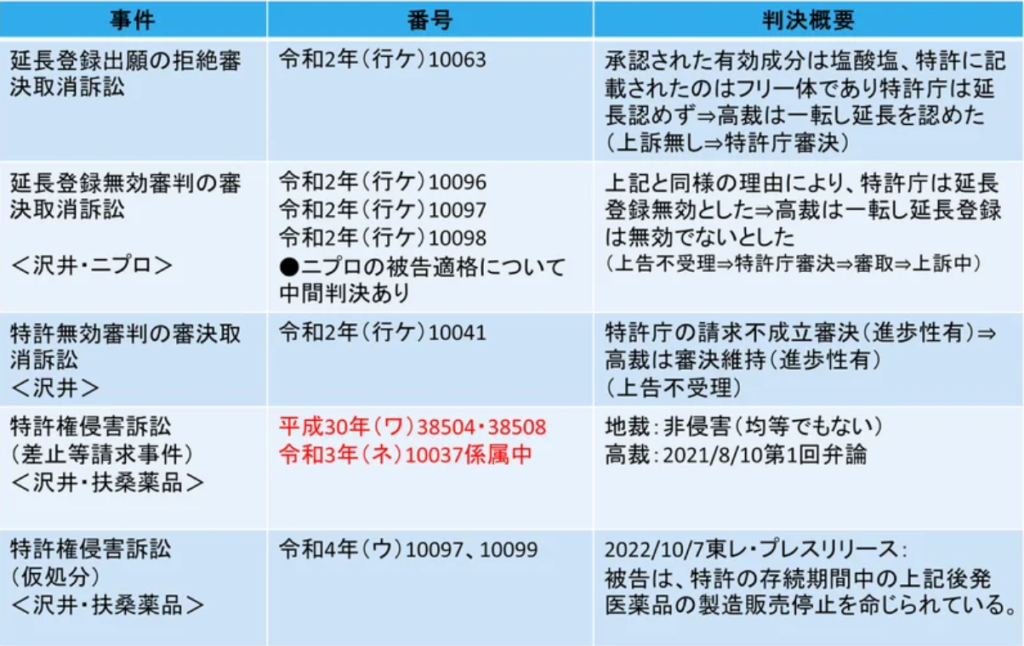
これら事件のうち、今回判決が出された表中の赤字で示した侵害訴訟事件についてもう少し詳しくお話しします。
先発品(レミッチ®カプセル2.5μg、レミッチ®OD錠2.5μg)は、ナルフラフィン塩酸塩を有効成分として含み、効能効果を血液透析患者におけるそう痒症、及び慢性肝疾患患者におけるそう痒症とする医薬品です。再審査期間は、「血液透析患者におけるそう痒症」用途(以下、「透析患者用途」)については2017年1月20日まで、「慢性肝疾患患者におけるそう痒症」用途(以下、「肝疾患患者用途」)については2018年12月25日まででした。一方、先発品を保護する止痒剤用途に関する特許(特許第3531170)は出願日が1997年11月21日であり、20年後の存続期間は2017年11月21日でした。
先発特許に関しては合計4件の延長登録出願がされており、2017年11月21日時点の特許期間延長の状況を確認すると、2015年3月の肝疾患患者(カプセル)用途の承認に基づく延長登録出願(特願2015-700061)により、2015年3月25日に5年の延長を得ていた。2017年3月の透析患者・肝疾患患者用途(OD錠)に基づく延長登録出願(特願2017-700154)は、2018年6月時点で拒絶査定不服審判に係属中だったため、延長登録出願の効果として、拒絶査定確定または延長登録までは、存続期間は延長されたものとみなされます(第67条の2第5項)。さらに2017年9月の腹膜透析・慢性肝疾患(カプセル)の承認に基づく延長登録出願(特願2017-700309)と、腹膜透析・慢性肝疾患(OD錠)の承認に基づく延長登録出願(特願2017-700310)は係属中であり、その後2018年7月に延長登録されています。
ここでもし特許期間延長を考慮しなければ、透析患者用途については、再審査期間が経過する2017年1月20日以降に、後発品が申請を行うと、特許満了後の2018年2月に承認され同年6月に薬価収載されることになります。しかし上述の通り、存続期間は延長されたものとみなされる状態でした。この様な状況下、後発沢井製薬と扶桑薬品は、2018年2月に承認を取得、同年6月に薬価収載し販売を開始しました。そこで特許権者は2018年12月13日に沢井製薬と扶桑薬品を相手取り、東京地裁に特許権侵害差止等請求訴訟を提起しました(平成30年(ワ)38504他)。
ここで、先発特許の請求項1は、「一般式(I)(中略)で表されるオピオイドκ受容体作動性化合物を有効成分とする止痒剤。」であり、一般式(I)で表されるオピオイドκ受容体作動性化合物には、ナルフラフィン(フリー体)(本件化合物)が含まれます。一方被告製品(後発品)は、ナルフラフィン塩酸塩を含みます。なお、ナルフラフィン塩酸塩は体内でナルフラフィン(フリー体)となり治療効果を発揮します。
地裁では、争点①:被告ら製剤は本件化合物であるナルフラフィン(フリー体)を「有効成分」とするものか、争点②:被告ら製剤は本件発明に記載された構成と均等なものか、の2つが争点となりました。2021(R3)年3月30日の判決では、被告製剤は、本件化合物であるナルフラフィン(フリー体)を「有効成分」とするものとは認められず、構成要件Aを充足しないこととなり、また、本件発明に記載された構成と均等なものとして、本件発明の技術的範囲に属するということもできない、として被告製品(後発品)は非侵害と判断されました。これに対して、原告東レ(特許権者)は知財高裁に即日控訴しました。
なお、争点①の判断において、「有効成分」という用語の意味について、特許明細書中に特段の定義はないため、本件発明において、この「有効成分」という用語は、医薬品の分野における当業者が理解する通常の意味で用いられているというべきである旨が示されています。その上で、この分野の辞書、教科書、日本薬局方の記載を参照し、「有効成分」に当たるものは、本件化合物であるナルフラフィン(フリー体)ではなく、その酸付加塩であるナルフラフィン塩酸塩であると結論付けました。
また争点②の判断において、均等論に関する最高裁判決2件(ボールスプライン事件:最高裁平成10年2月24日第三小法廷判決・民集52巻1号113頁、マキサカルシトール事件:最高裁平成29年3月24日第二小法廷判決・民集71巻3号359頁)に基づいて、出願人たる原告は、本件明細書の記載に照らし、本件特許出願時に、その有効成分となるオピオイドκ受容体作動薬として、本件化合物を有効成分とする構成のほかに、その薬理学的に許容される酸付加塩を有効成分とする構成につき容易に想到することができたものと認められ、それにもかかわらず、これを特許請求の範囲に記載しなかったというべきである、との旨が示されました。
以上は本案訴訟の進捗ですが、その後驚くべきことに、2022年10月7日付けの東レのプレスリリースにて、東レは本訴の他に仮処分の申立も行っており、同日付けで知財高裁から沢井製薬と扶桑薬品に対して、経口そう痒症改善剤レミッチ®OD錠の後発医薬品の製造販売差止仮処分命令が発出されたことが報じられました。同プレスリリースによると、「本件仮処分手続は、東レが製造販売承認を取得している経口そう痒症改善剤「レミッチ®」(「レミッチ®カプセル2.5µg」および「レミッチ®OD錠2.5µg」(一般名:ナルフラフィン塩酸塩)、以下「本剤」)に関する用途特許(特許第3531170号、延長登録:特願2017-700154号1及び特願2017-700310号2)に基づき、本剤の後発医薬品である「ナルフラフィン塩酸塩OD錠2.5µg『サワイ』」および「ナルフラフィン塩酸塩OD錠2.5µg『フソ-』」の製造販売差止を求めたものです(令和4年(ウ)第10097号および令和4年(ウ)第10099号)。」とのことでした。
さらに「本件仮処分命令により、沢井製薬株式会社および扶桑薬品工業株式会社は、上記用途特許の存続期間中の上記後発医薬品の製造販売停止を命じられております(用途を血液透析患者、慢性肝疾患患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)とするものについては令和4年11月16日が経過するまで、用途を透析患者(血液透析患者を除く)におけるそう痒症の改善(既存治療で効果不十分な場合に限る)とするものについては令和4年11月21日が経過するまでの間)。」という旨も報じられました。
侵害訴訟の本訴第一審では、被告製品は非侵害と判断されていましたので、このニュースは業界に大きな衝撃を与えました。と共に、現在知財高裁に係属中の本訴の行方が気になります。さらにこのような中、扶桑薬品が2024年3月27日に、原告から損害賠償請求額を拡張する旨の「訴えの変更申立書」が提出されたことを同社のプレスリリースで発表しました。それによると、2024(R6)年3月22日に原告は、4,000万円及び遅延損害金であった損害賠償請求金額を、82億2,400万8,830円及び遅延損害金へと拡張したとのことです。(沢井製薬に対する請求額は非公開)
まず、最初の後発品が、先発特許の出願から20年を経過していたものの、延長登録出願により延長登録がされたものとみなされている時期、つまり特許が有効とみなされている時期に承認されていることに注目しました。(パテントリンケージは?!)
後発品の審査(つまり、パテントリンケージ)で、侵害訴訟の第一審や延長登録無効審判の特許庁の判断のように、後発品の有効成分(ナルフラフィン塩酸塩)は、先発特許の範囲に入らないという判断がされた上で、先発の用途特許が有効に存続しているにも関わらず後発品が承認されたということなのでしょうか?
次に、極めて妥当と思われた侵害訴訟の第一審における先発特許への文言侵害・均等侵害に関する判断が、その後一転した点について注目しました。
実はこの判断が一転する可能性は、2021年3月25日に一斉に下された、先発特許の4件の延長登録ないし出願に関する審決取消訴訟の判決からある程度予想できていました。この判決において、延長登録の基礎となる薬事承認の内容について、承認書の「有効成分」の記載内容から形式的に判断すべきではない、医薬品について、良好な物性と安定性の観点からフリー体に酸等が付加されて、フリー体とは異なる化合物(付加塩)が医薬品とされる場合があること、そのような医薬品が人体に取り込まれたときには、付加塩からフリー体が解離し、フリー体が薬効及び薬理作用を奏すること、ナルフラフィンとナルフラフィン塩酸塩についても同様の関係にあり、ナルフラフィンとナルフラフィン塩酸塩で薬効及び薬理作用に違いがないことが知られている等として、延長登録を認めないという特許庁の審決が全て取り消されました。つまり、ナルフラフィン塩酸塩を含有する医薬品の承認に基づいてナルフラフィン(フリー体)は記載されているが、ナルフラフィン塩酸塩は記載されていない特許権を延長可能と判断されたのです。侵害訴訟第一審の判断が極めて妥当と思われた一方、なぜここまで柔軟に(寛容に?)解釈する必要があるのか、という気持ちを消し去ることができないのは筆者だけでしょうか。さらに、個別具体的に本件を考えたときにはこのように解釈しうる何らかの事情が存在したとしても、このような先例はこの後の、何らの事情の存在しない案件にも影響することを考えると、やはり完全には腑に落ちないものがあります。
最後に損害賠償に関して、先発対後発医薬品の特許係争において、先発の特許権侵害に基づく損害賠償が認められた事例は、最近ではマキサカルシトール事件のみで、その額も全被告への合計で約10億7,000万円及び遅延損害金でした。本件ではそれを超える額の損害賠償請求が出される可能性が有り、この点からも知財高裁の判決に注目が集まっています。
というのが、知財高裁から仮処分が出された後、2024年半ばまでの状況でした。仮処分の決定は公開されませんので結論以外はわかっていません。2025年5月27日付けの判決文にはどのような根拠が記載されているか、楽しみです。
(執筆者:田中康子)
*************************************************************************
発行元 エスキューブ株式会社/国際特許事務所
〒105-0001 東京都港区虎ノ門5丁目12番8号 クローバー神谷町601
Tel 03-6712-5985
Website www.s-cubecorp.com
*************************************************************************
本ブログの無断転載はご遠慮下さい。
ブログの記載内容については正確を期しておりますが、弊所は、利用される方がこれらの情報を用いて行う一切の行為について責任を負うものではありません。