
-
お電話でのお問い合わせ03-6712-5985
- お問い合わせ
お電話でのお問い合わせ03-6712-5985


エスキューブ知財ニュース2023年2月号をお届けします。
エスキューブ知財ニュースは、知財実務に直結する制度や改正法の情報に関する「今月のヘッドライン」と、医薬品分野のトピックに関する「医薬品知財情報アップデート」の二部構成にて毎月発行の予定です。なお、医薬品関連の審判決については「医薬品審判決情報」をご覧ください。
━━Contents━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━
[1] 今月のヘッドライン:権利回復の要件緩和・改正特許法等4月1日施行予定
■特許権等の権利回復救済措置の要件緩和・2023年4月1日施行予定
[2] 医薬品知財情報アップデート
■アステラス製薬「レキスキャン」・米控訴裁判も後発品の特許侵害を否定
■厚労省・有識者検討会「後発品置換バイオシミラー促進策の必要性を議論」
■東和薬品・特許権侵害しない旨を主張「トレアキシン後発品特許侵害訴訟」
■千寿製薬・眼科用VEGF阻害剤における初のバイオシミラーに関し「糖尿病黄斑浮腫」の追加適応症の承認取得
━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━
特許権等が手続期間の徒過により消滅した場合に「権利を回復できる要件を緩和」する令和3年改正特許法が4月1日より施行予定です。
(1)法改正の必要性
特許法条約(PLT)上、我が国の権利回復のための判断基準は「相当な注意基準」を採用し、国内法上「正当な理由がある」ことを要件に規定していました。現行法では「正当な理由」の判断は、処分が行政争訟の対象となることも念頭に、事実認定や証拠の採否等、慎重な運用が行われてきました。
しかし、近年、国内外の出願人等から、日本の権利等の回復のための判断基準及び立証負担は、欧米諸国に比して厳格過ぎるとの指摘を受けていること、また回復申請に対する認容率(約10~20%)が突出して低いことから改善要望が寄せられていました。
(2)「故意でない基準」への転換
そこで、PLTにおける権利等の回復のための要件を「相当な注意基準」から「故意でない基準」に転換し、特許法等において、手続期間を徒過した場合に救済を認める要件について、「(手続をすることができなかったことについて)正当な理由がある」から「(手続をしなかったことが)故意によるものでない」に改めることとしました。
(3)回復手数料の徴収
権利の回復基準を「故意基準」に転換すれば、権利の回復は容易となるところ、制度の濫用を防ぐとともに、手続期間の遵守のインセンティブとするために十分な程度の回復手数料を徴収するとし、具体的金額は政令で定めることとしています。なお、災害や感染症等によって、手続期間の徒過が出願人等の責めに帰することができない場合には、回復手数料の免除規定が設けられています。
(4)法改正によって対象となる手続
【特許法による手続】
① 外国語書面出願の翻訳文(第36条の2第6項)
② 特許出願等に基づく優先権主張(第41条第1項第1号)
③ パリ条約の例による優先権主張(第43条の2第1項)
④ 出願審査の請求(第48条の3第5項)
⑤ 特許料の追納による特許権の回復(第112条の2第1項)
⑥ 外国語でされた国際特許出願の翻訳文(第184条の4第4項)
⑦ 在外者の特許管理人の特例(第184条の11第6項)
【実用新案法による手続】
⑧ 実用新案登録出願等に基づく優先権主張(第8条第1項第1号)
⑨ パリ条約の例による優先権主張(第11条第1項で準用する特許法第43条の2第1項)
⑩ 登録料の追納による実用新案権の回復(第33条の2第1項)
⑪ 外国語でされた国際実用新案登録出願の翻訳文(第48条の4第4項)
⑫ 在外者の実用新案管理人の特例(第48条の15第2項で準用する特許法第184条の11第6項)
【意匠法による手続】
⑬ パリ条約の例による優先権主張(第15条第1項で準用する特許法第43条の2第1項)
⑭ 登録料の追納による意匠権の回復(第44条の2第1項)
【商標法による手続】
⑮ 商標権の回復(第21条第1項)
⑯ 後期分割登録料等の追納による商標権の回復(第41条の3第1項)
⑰ 防護標章登録に基づく権利の存続期間の更新登録(第65条の3第3項)
⑱ 書換登録の申請(附則第3条第3項)
▼詳しくは特許庁ウェブサイトをご覧ください。
・https://www.jpo.go.jp/system/laws/rule/kaisetu/2022/document/2022-42kaisetsu/05.pdf
アステラス製薬株式会社(東京都中央区)は、1月4日付のニュースリリースで、米国で販売している心機能検査補助剤Lexiscan®(レキスキャン)について、米国Hospira社の後発医薬品による特許侵害は認められないとする判決を受けたことを発表しました。
米国連邦巡回区控訴裁判所(CAFC)は2022年12月30日、米国デラウェア州連邦地方裁判所の判決を支持する判決を下しました。
また、Hospira社によるLexiscan®の後発品発売に対する一時停止措置は失効し、CAFCはアステラス製薬の上訴期間中におけるHospira社によるLexiscan®の後発品の発売停止を求める仮差し止め請求も却下しました。
アステラス製薬は「Hospira社によるLexiscan®の後発品発売を停止するための法的措置を検討しています」とコメントしています。
▼ニュースリリースはこちらをご覧ください。
・https://www.astellas.com/jp/news/26911
厚生労働省は1月26日、革新的な医薬品や医療ニーズの高い医薬品の日本への早期上市や医薬品の安定的な供給を図る観点から、流通、薬価制度、産業構造の検証など幅広い議論を行う必要があるため「医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会」を開催し、課題である特許満了後の後発品への置き換えについて、バイオシミラー促進策の必要性を議論しました。
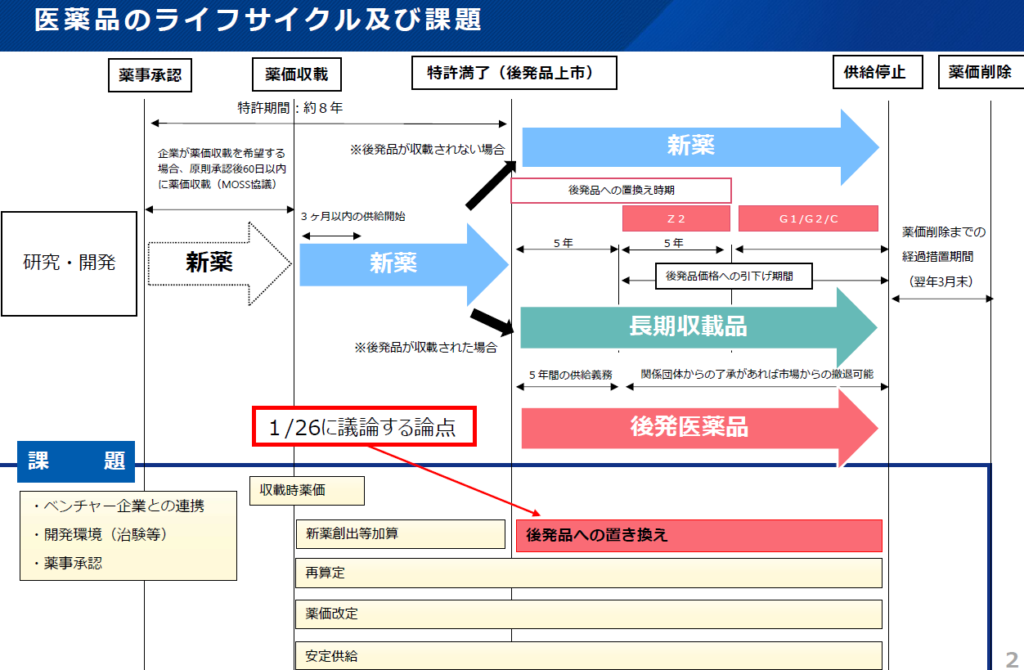
●バイオ後続品(バイオシミラー)について
後発医薬品の置き換えについて、バイオシミラー促進策の必要性について議論され、長期収載品の国内売上高のうち、バイオ医薬品の額は現時点で低い一方で、その比率が近年増加中であることや、将来的にバイオ医薬品の特許が切れていくことを踏まえると、バイオシミラーの置き換えに注力していくべきであると指摘しています。
●バイオ関連医薬品の大幅な輸入超過問題
日本におけるバイオ関連医薬品について、現状は大幅な輸入超過となっており、さらに輸入が急速に増加している問題で、バイオ医薬品については国内生産への高いニーズがあると指摘しています。
しかしながら、薬価収載されているバイオ医薬品(508品目)のうちバイオシミラーは107品目あり、バイオシミラーの製造販売業者(20社)のうち、、国内で製造している製造販売業者は3社(19品目5成分)にとどまっていると説明しています。
さらに、現状はグローバルで競争力のある国内バイオ医薬品製造業者が少ないことが課題として指摘されいています。世界的にはロンザ(スイス)やサムスンバイオロジクス(韓国)などがグローバル大手として活躍し、グローバルにおける日本企業の存在感は大きくないと指摘しています。
●バイオシミラーに係る政府方針
「バイオシミラーについて、医療費適正化効果を踏まえた目標値を今年度中に設定し、着実に推進する。」また「バイオシミラー(国内で承認されたバイオ医薬品と同等の品質等を有する医薬品)の開発・利用の促進のため、2022年度中に今後の政府目標を策定。これを踏まえ、その利用促進のための具体的な方策を検討し、2024年度を目途に結論を得る。」としています。
▼有識者検討会資料はこちらをご覧ください。
・https://www.mhlw.go.jp/content/10807000/001045122.pdf
東和薬品株式会社(大阪府門真市)は、1月13日付のプレスリリースで、同社が製造販売するのベンダムスチン塩酸塩点滴静注液「トーワ」が、先発品である「トレアキシン」の特許権を侵害するとして、先発品の製造販売元のシンバイオ製薬とライセンス元の米国Eagle社から提訴された件について、「当社は、裁判において当該特許権を侵害しない旨を主張し争っていく方針である」と発表しました。
東和薬品は、トレアキシン®の後発医薬品の製造販売が承認された同社が後発品の販売を開始したため、昨年12月にシンバイオ製薬とEagle社から提訴されていました。
▼プレスリリースはこちらをご覧ください。
・https://www.towayakuhin.co.jp/pdf/news230113.pdf
千寿製薬株式会社(大阪市中央区)は、1月13日付のニュースリリースで、眼科用VEGF阻害剤・ラニビズマブBS硝子体内注射用キット10mg/mL「センジュ」に関し、新たな適応症である「糖尿病黄斑浮腫」に対する医薬品製造販売承認事項一部変更承認申請(一変申請)の承認を取得したことを発表しました。
本剤は眼科用VEGF阻害剤における初のバイオシミラーであり、このたび「効能・効果」として、「中心窩下脈絡膜新生血管を伴う加齢黄斑変性」と「病的近視における脈絡膜新生血管」に加えて、「糖尿病黄斑浮腫」が追加されたことで、千寿製薬は「これらの疾患に対する薬物治療の選択肢を広げるとともに、患者様の経済的負担の軽減に貢献できるものと考えております。」とコメントしています。
▼ニュースリリースはこちらをご覧ください。
・https://www.senju.co.jp/sites/default/files/content_news/2023-01/JPN_20230113.pdf
*************************************************************************
発行元 エスキューブ株式会社/国際特許事務所
〒105-0001 東京都港区虎ノ門5丁目12番8号 クローバー神谷町601
Tel 03-6712-5985 Fax 03-6712-5986
Email info@s-cubecorp.com
Website www.s-cubecorp.com
*************************************************************************
本エスキューブ知財ニュースの無断転載はご遠慮下さい。
ニュースの記載内容については正確を期しておりますが、弊所は、利用される方がこれらの情報を用いて行う一切の行為について責任を負うものではありません。