
-
お電話でのお問い合わせ03-6712-5985
- お問い合わせ
お電話でのお問い合わせ03-6712-5985

先発対後発両サイドの特許戦略に必要不可欠な知識や最近の話題をお届けする「医薬品特許戦略ブログ」を配信します。製薬関連企業の皆様はもちろん、アカデミアや投資家の皆様にも参考にしていただけるような、実践的なポイントをお届けしたいと思います。
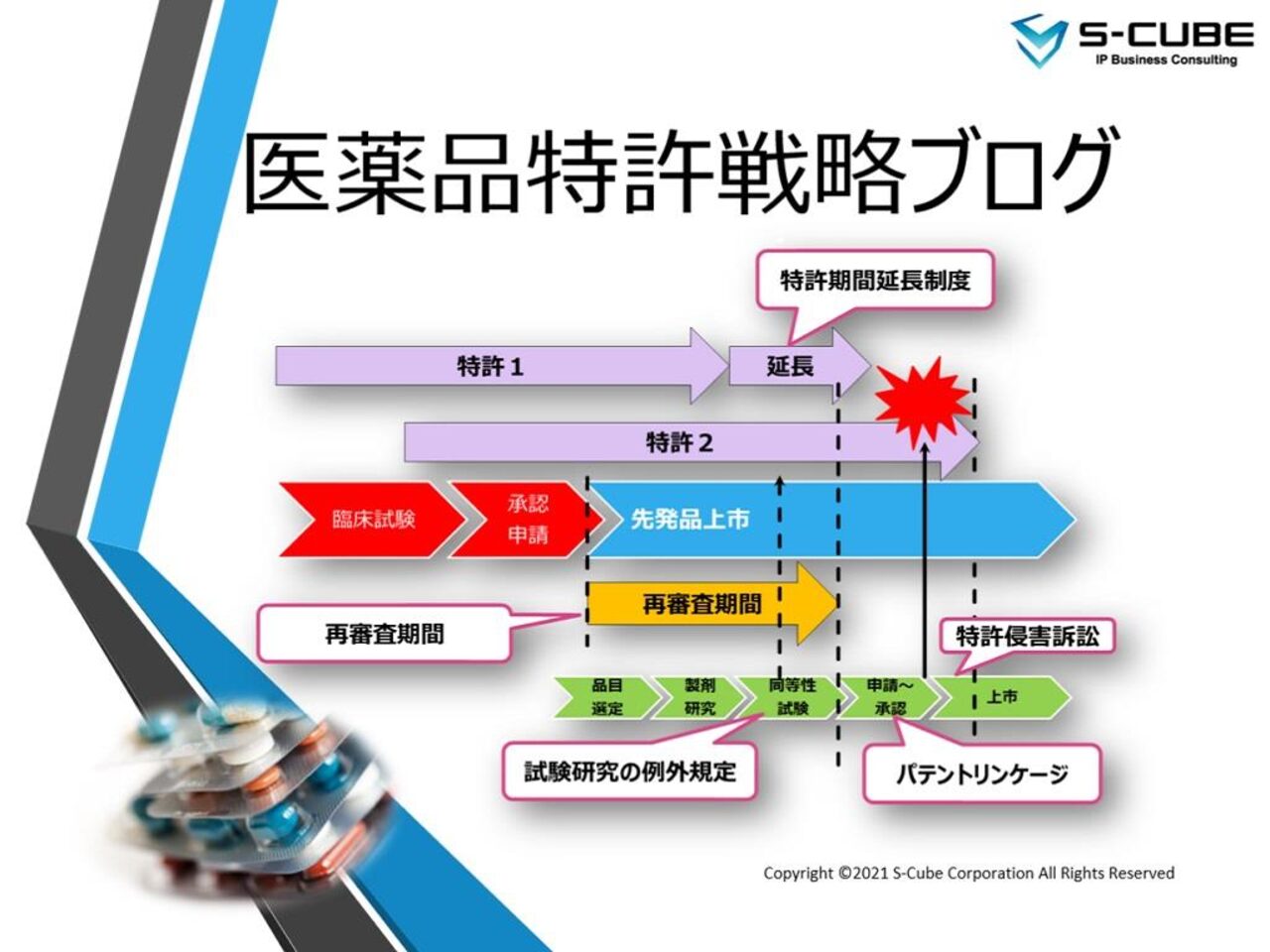
日本には、パテントリンケージについて定めた法律や規則はない。しかしながら、厚生労働省の2つ通知に基づいて、後発医薬品の審査(第一段階)と、 承認後かつ薬価基準収載前 (第二段階)の二段階で実施されている、という建前になっている。
一つ目の通知は、平成 21 年6月5日付け医政経発第 0605001 号・薬食審査発第 0605014 号であり、 厚生労働省の医政局経済課長及び医薬食品局審査管理課長の二人の課長の連名による通知(通称「二課長通知」)である。
同通知では、医薬品の安定供給を図る観点から、PMDA(独立行政法人医薬品医療機器総合機構)における後発医薬品の承認審査の中で、先発医薬品の特許(物質特許・用途特許)への抵触について確認することが示されている。すなわち、同通知が後発品審査でのパテントリンケージ(第一段階)の根拠となっている。また同通知は、平成6年10月4日付けの通知(「承認申請に係る医薬品特許情報の取扱いについて」(平成6年 10 月4日付け薬審第 762 号)及び「医療用後発医薬 品の薬事法上の承認申請及び薬価収載に係る医薬品特許の取扱いについて」(平成 21 年6月5日付け医政経発第 0605001 号・薬食審査発第 0605014 号)) を一部変更するものであり、パテントリンケージの運用自体は、この平成6年の通知以降行われていたことになるが、二課長通知により、先発医薬品の物質特許に加えて用途特許も考慮することが明確にされた。
さらに同通知には、先発医薬品の一部の効能・効果等に特許が存在し、その他の効能・効果等を標ぼうする医薬品の製造が可能である場合は後発医薬品を承認できること(上述の「虫食い申請」)も含まれている。
二つ目の通知は、平成21年1月15日付け医政経発第0115001号である。
同通知には、後発医薬品の薬価基準への収載前に、医薬品の安定供給を図るため、特許係争のおそれがある品目の収載を希望する場合は、当事者間で調整(事前調整)を行い、安定供給が可能と思われる品目についてのみ収載手続を執ること、が示唆されている。すなわち、同通知が、承認後かつ薬価基準収載前のパテントリンケージ(第二段階、事前調整)の根拠となっている。
パテントリンケージの第一段階、第二段階は次の通りである。
第一段階(審査段階:申請~審査~承認)
後発医薬品が厚労省に申請されると、PMDAでの審査を経て約1年で承認される。パテントリンケージ第一段階の根拠となっている「二課長通知」には、審査において「先発医薬品の特許に抵触していないこと」を確認するとある。先発医薬品の特許は、医薬品特許情報報告票に掲載されている特許を示す。
医薬品特許情報報告票とは、先発企業が新薬の申請を行う際に厚労省に提出する先発医薬品に関する特許リストである。米国のオレンジブックに掲載された特許情報に対応するが、公開はされない。特許情報は、再審査期間(再審査期間とは、薬機法第14条の4で定める再審査(新薬承認後一定期間経過後に、承認された効能効果、安全性について、再度確認する制度)に基づく期間であり、新薬では8年である。(https://www.cao.go.jp/consumer/history/01/kabusoshiki/tokuho/doc/110228_shiryou5.pdf)が終了するまで追記可能である。医薬品特許情報報告票の提出やいかなる特許情報を記載するかは、義務付けられておらず、新薬申請者の努力目標という位置づけである。
二課長通知により、パテントリンケージの第一段階では、医薬品特許情報報告票に記載された物質・用途特許と、後発医薬品との関係を確認することになっており、それ以外の特許(製剤特許、製法特許等)は第一段階では参照されない。そして上述の通り、医薬品特許情報報告票の提出や記載内容に関する規定はないので、物質・用途特許に記載漏れがあっても、物質・用途特許以外の特許が記載されていてもペナルティはない。
また、二課長通知には明記されていないが、後発品申請時に添付すべき「承認後速やかに製造または輸入販売できることを示す資料」には、特許無効審決書と裁判判決文が挙げられていることから、第一段階では、先発特許への侵害性だけでなく特許の有効性も確認しているものと推測される(篠原勝美「日本型パテントリンケージ制度の諸問題(上)」篠原勝美L&T 80, 29~35 (2018))。
二課長通知によれば、先発特許と後発医薬品の関係は、後発医薬品の承認予定日を基準に判断する。つまり先発特許が特許無効審判に係属中の場合は、承認予定日に事件が確定していなければ後発医薬品は承認されないものと思われる。
ここで、特許審判事件は、特許庁の審決の後、知財高裁、さらに最高裁へと上訴の道がある。審決や判決で、下級審への差し戻しが命じられる場合を考慮すると、差し戻しと上訴の繰り返しにより、特許庁の最初の審決から確定まで、相当の期間を要する場合もある。そのため、後発医薬品が申請されても、無効審判が確定しないことにより相当期間承認されない可能性がある。
第二段階(事前調整:承認~薬価基準収載)
医療用医薬品は厚労省の承認を受けた後、薬価基準収載(薬の価格の登録)がされると販売可能になる。承認を受けた者は、一定期間内に薬価基準収載の申請をする必要がある。
後発医薬品の承認は、現在年2回(2月と8月)に行われている。薬価基準収載も年2回(6月と12月)であり、2月に承認された後発医薬品は、最短で同じ年の6月に、8月に承認された場合は12月に薬価基準収載されうる。後発医薬品が承認されると承認情報が日薬連のホームページに掲載され、それにより先発企業は後発医薬品の存在を知ることになる。
後発医薬品承認の時期が近づくと、その都度、PMDAから日薬連を通じて、日薬連の会員企業に対し、特許係争のおそれがあると思われる品目の薬価収載を希望する場合は、事前に当事者間で調整を行い、指定期日までに調整の結果を厚生労働省に提出するよう通達がある。
パテントリンケージの第一段階で、物質・用途特許については確認が済んでいるため、第二段階ではそれ以外の製剤特許・製法特許などへの抵触有無について確認することになる。
通常、先発企業が自社特許への抵触を懸念する後発医薬品を見つけた場合、直接後発企業にコンタクトすることにより、話し合い(事前調整)が始まる。事前調整が行われた場合、両当事者は、話し合いを開始した時点及び事前調整期間終了の時点で、厚生労働省に報告をしなければならない。
厚生労働省への報告は義務づけられているが、あくまでも報告をすればよいので、両者による話合がまとまっている必要はない。よって、事前調整が行われた後に薬価が収載されても、特許抵触がないことを意味するわけではない。
薬価収載後に特許訴訟に発展する場合があるし、薬価収載を阻止すべく、収載前に特許侵害訴訟が提起される場合もある。
尚、既に最初の承認がされた後発医薬品の、追加承認で、薬価がすでに収載されている場合は、承認後薬価基準収載されなくても販売可能である。このような場合は、パテントリンケージ第二段階のチャンスは事実上存在しないことになる。
*************************************************************************
発行元 エスキューブ株式会社/国際特許事務所
〒105-0001 東京都港区虎ノ門5丁目12番8号 クローバー神谷町601
Tel 03-6712-5985 Fax 03-6712-5986
Email info@s-cubecorp.com
Website www.s-cubecorp.com
*************************************************************************
ブログの記載内容については正確を期しておりますが、弊所は、利用される方がこれらの情報を用いて行う一切の行為について責任を負うものではありません。