
-
お電話でのお問い合わせ03-6712-5985
- お問い合わせ
お電話でのお問い合わせ03-6712-5985

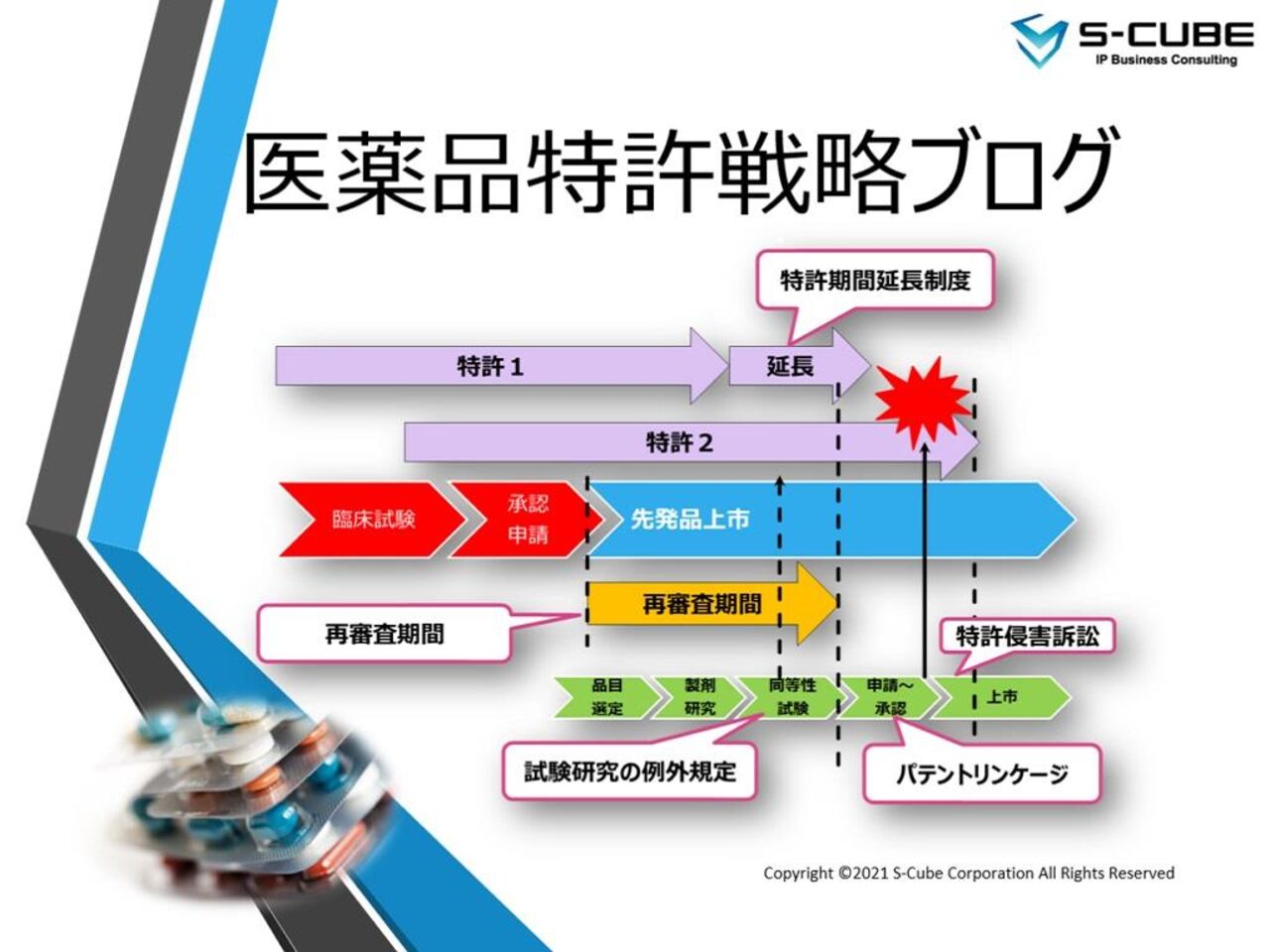
先発対後発両サイドの特許戦略に必要不可欠な知識や最近の話題をお届けする「医薬品特許戦略ブログ」を開始します。製薬関連企業の皆様はもちろん、アカデミアや投資家の皆様にも参考にしていただけるような、実践的なポイントをお届けしたいと思います。
医薬品は、医師の処方箋により購入可能な医療用医薬品と、誰もが購入可能なOTC(Over-the-Counter)医薬品に分けられます。このうち医療用医薬品は、医薬品医療機器等法(薬機法)に基づき、製造から市販後の安全対策まで一貫して厚労省によって規制されていますので、製造・販売するためには当局指定の試験(臨床試験)を行ったうえで製造承認を受ける必要があります。医療用医薬品は、さらに先発医薬品と後発医薬品に分類されます。
先発医薬品は、いわゆる新薬のことで、先発品や先発薬とも呼ばれます。後発医薬品は、先発医薬品の特許が切れた後に、先発医薬品と成分や規格等が同一で、生物学的に同等であるとして承認される医薬品で、後発品や後発薬とも呼ばれます。
もう少し詳しく説明しますと、先発医薬品のうち、有効成分が低分子化合物であるものを低分子医薬品、有効成分が抗体やタンパク質などの高分子化合物であるものはバイオ医薬品と呼ばれます。これに対応して後発医薬品のうち低分子のものをジェネリック医薬品(以下、ジェネリック)、高分子のものをバイオ後続品やバイオシミラーと呼びます。以上の分類を図に表すと次のようになりますよ。
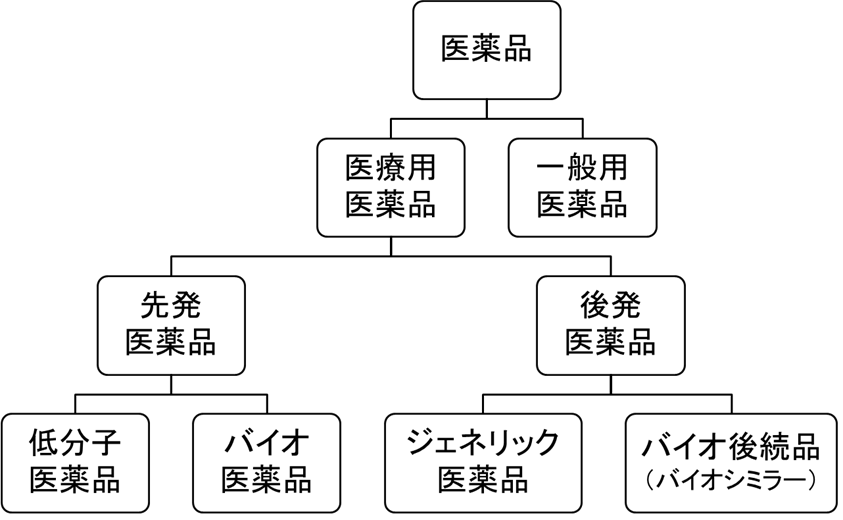
なお、ジェネリックとバイオ後続品では、厚労省に提出するために必要な試験の種類が違います。ジェネリックでは、最低限先発医薬品との同等性を示す試験を行えばよく、治験は不要ですが、バイオ後続品では、高分子化合物の性質から、先行バイオ医薬品と全く同一のものは通常製造できないため(故にバイオシミラーとも呼ばれる)、治験が必要です。そのため、ジェネリックでは、開発期間3~4年、開発費用が1億円程度であるのに対し、バイオ後続品では、開発に6~12年、費用は200億~300億円程度かかるといわれています。
(執筆者:田中康子)